新疆大学药学院(药物研究所)范仲雄和李金耀、厦门大学杨立朝、中国科学院兰州化学物理研究所海军研究员等在国际知名期刊《Chemical Engineering Journal》(中科院一区TOP,影响因子13.40)在线刊发了题为“Metformin-induced precise targeted inhibition of ischemic neuronal death by a programable endogenous ROS-responsive nanoprodrug”的研究成果。

脑卒中(俗称“中风”),常见于急性缺血性脑卒中(AIS),正逐渐成为仅次于癌症的重大疾病之一,无数患者深受其害,这给予了个人家庭和社会极大的经济负担。随着纳米医学的迅猛发展,形态各异、功能丰富的生物材料正流行于神经科学领域而广受研究人员的青睐。与此同时,一个不容忽视的问题也悄然出现——纳米材料的安全性,正所谓药物基于设计,但这种过度设计很可能会带来无法预测的潜在危害,并且繁琐的药物生产流程也不可避免地增加了转化的负担。另一方面,包括一些纳米药物在内的AIS治疗主要集中在疏通血栓上,这些治疗策略本质上并不能防止血流再灌过程中活性氧(ROS)快速积累所造成的永久性损伤。因此,如何有效地清除再灌注后的自由基的同时又尽可能减少由于材料引入的安全性问题成为了AIS纳米治疗应用策略亟待解决的问题。
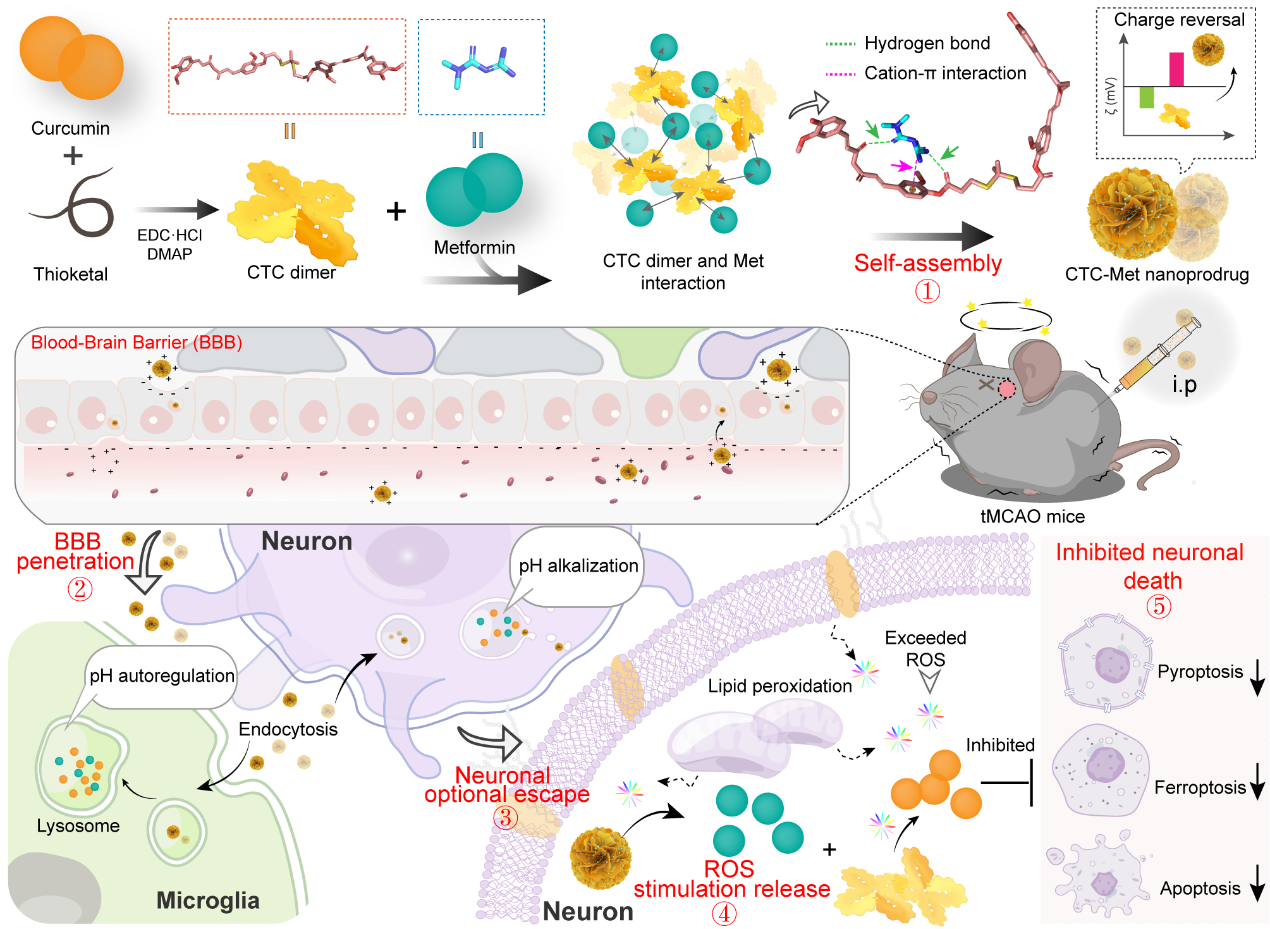
基于上述现状,该研究团队制备了一种ROS触发的电荷逆转优先靶向神经元无载体纳米前药CTC-Met,旨在通过精确靶向抑制神经元死亡来改善AIS。研究结果表明,通过药物之间的互作可以将负电荷CTC药物修饰成了正电荷CTC-Met前药分子,并通过正电荷主导的胞吞作用穿过BBB,而迅速积累到脑组织中,然后内吞入小胶质细胞和神经元中。有趣的是,CTC-Met还可以通过Met抑制V-ATP酶的生理活性来增强神经元的溶酶体逃逸。此外,体外和体内实验结果共同证明,CTC-Met可以在AIS-内源性活性氧的触发下实现Cur和Met的时空按需药物释放。最后,释放的Cur可以消除活性氧,重塑大脑中的氧化还原平衡,减轻神经元死亡;同时通过引入Met减少Cur的毒性作用,从而达到在AIS治疗期间“减压增效”的最终目的。
总体而言,这些新发现为AIS治疗和与氧化应激相关的脑部疾病提供了一种有效且有前途的治疗策略,有望拓宽无载体纳米前药的生物医学应用并加速其临床转化。
厦门大学已毕业硕士研究生谭晓锋、厦门医学院李莹和厦门大学博士后金昊为该论文的共同第一作者,新疆大学药学院(药物研究所)范仲雄和李金耀、厦门大学杨立朝、中国科学院兰州化学物理研究所海军研究员为该论文的通讯作者。论文链接:https://www.sciencedirect.com/science/article/pii/S1385894725029328