2025年2月1日,新疆大学李金耀教授和范仲雄副教授联合中国科学院兰州化学物理研究所海军研究员等在国际知名期刊《Materials Today Bio》(中科院一区)在线刊发了题为“NIR-triggered programmable nanomotor with H2S and NO generation for cascading oncotherapy by three-pronged reinforcing ICD”的研究成果。

随着纳米医学的发展,气体治疗(GT)作为一种安全且有效的治疗方式正引起人们的广泛关注。与此同时,具有可控释放功能的刺激响应性纳米平台的设计为疾病治疗提供了新的解决方案。免疫原性细胞死亡(ICD)可以通过触发肿瘤相关抗原和损伤相关分子模式的释放,产生一种原位肿瘤疫苗来激活抗肿瘤免疫反应。近年来,以光动力治疗(PDT)为代表的新型肿瘤治疗策略,在诱导ICD,引发肿瘤细胞强氧化损伤以及产生抗肿瘤协同作用方面表现出了独特的优势。但即便如此,肿瘤细胞仍可重塑其代谢和表型,抑制免疫行为,逃避免疫清除,导致以上单一的治疗策略诱导的ICD免疫应答减弱。因此,如何通过多协同治疗激活肿瘤免疫反应从而增强治疗效果成为当前亟待解决的问题。
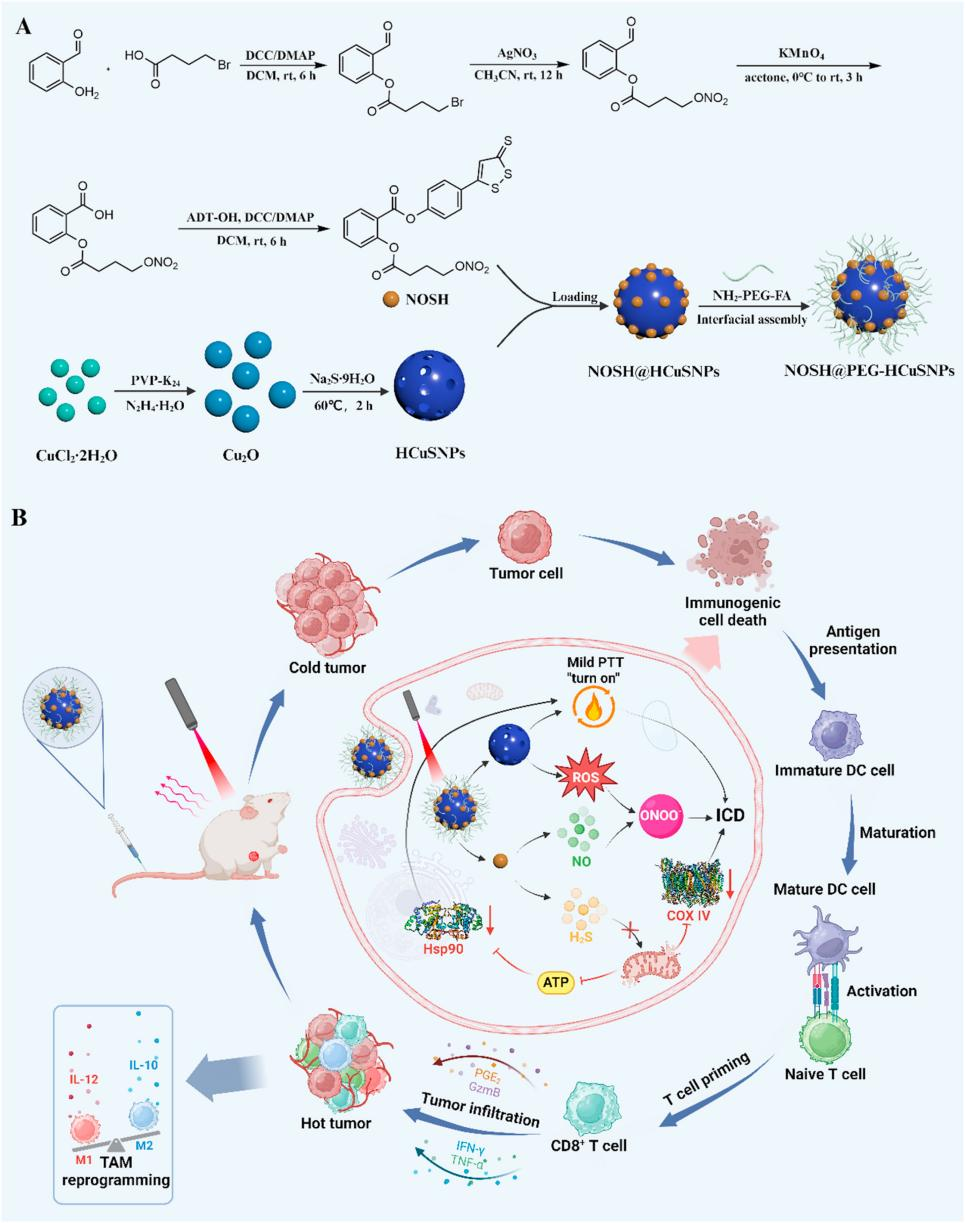
基于以上背景,该研究团队合成了能按需释放H2S和NO的气体信号分子供体NOSH,加载到具有近红外光(NIR)吸收能力和表面改性过的空心介孔硫化铜纳米颗粒中,以获得可编程纳米马达NOSH@PEG-HCuSNPs。研究发现,NOSH@PEG-HCuSNPs可以有效地实现NOSH和HCuSNPs的时空同步共同递送,从而发挥GT和轻度光热疗法(mPTT)的协同效应,即GT通过破坏线粒体呼吸链、抑制ATP产生和促进肿瘤细胞凋亡,有效增强mPTT的抗肿瘤反应。mPTT产生的ROS和NOSH释放的NO相互作用会产生大量的过氧亚硝酸盐阴离子(ONOO−)自由基杀伤肿瘤细胞。同时,利用H2S独特的保护机制,通过减少热休克蛋白90(HSP 90)的过表达来诱导肿瘤热消融,最大限度地减少对正常组织的不必要损伤。最后,mPTT、ONOO⁻自由基和H2S的级联效应显著增强了ICD。另外,免疫抑制性肿瘤微环境被重新编程,有效抑制了远处肿瘤组织并防止转移和肿瘤复发。综上所述,本研究为肿瘤治疗领域的创新提供了一个新的视角。
中国科学院兰州化学物理研究所张金龙副研究员为该论文的第一作者,新疆大学李金耀教授和范仲雄副教授、中国科学院兰州化学物理研究所海军研究员和裴栋研究员为该论文的通讯作者。