献礼我校百年校庆!!!近日,我校药学院王栋教授课题组,通过去芳构化-酸促进的亲电取代反应及消除反应策略,实现了喹啉3-位的直接烷基化及烯基化反应,相关研究成果以“Direct C3-H Alkylation and Alkenylation of Quinolines with Enones”为题发表在国际著名期刊 《德国应用化学》(Angewandte Chemie International Edition)上。
喹啉分子中C-H键向C-C键的转化,对于丰富制药和农用化学品的衍生物库,具有至关重要的意义。由于喹啉环电子特性,它的C2-和C4-位容易发生芳香亲核取代反应,C5-和C8-位易发生亲电芳香族取代反应,因此,喹啉C3-H键的直接官能化更具挑战性。
通过广泛的研究和理论计算,化学家们成功地开发了一系列高效的过渡金属催化剂和反应条件,以实现喹啉C3-H键的功能化。然而,这些方法有一些不可克服的局限性,如复杂的配体、环境污染问题、高温操作以及与溴化或碘化底物不相容。喹啉或吡啶的一种强大的C3-H键官能化策略是还原性去芳构化-重芳构化方法,通过1,4-还原性去芳构化反应形成二氢喹啉或二氢吡啶中间体,从而将最初缺乏电子的杂芳烃转化为富电子的烯胺中间体。这个方法主要问题是需要使用还原剂或氧化剂,而且需要预活化并分离去芳构化中间体。这些步骤可能会增加合成过程的复杂性和成本,同时也可能影响最终产物的纯度和产率。迄今为止,所有报道的方法都不能在氧化还原中性或无过渡金属的条件下实现喹啉3-位的烷基化或烯基化反应。
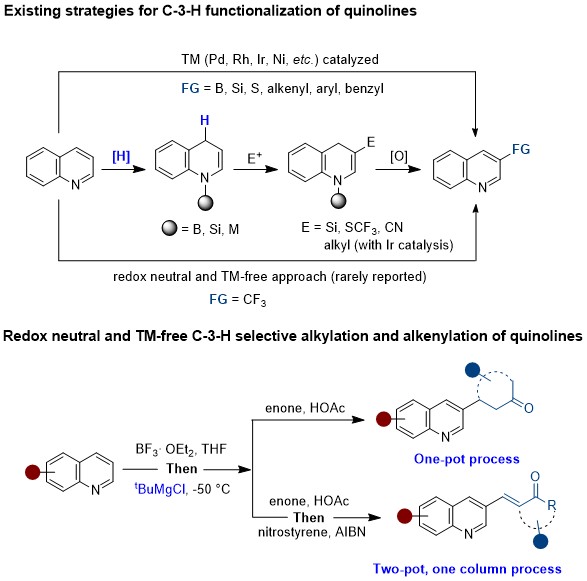
该论文首次报道了无过渡金属条件下实现喹啉C3-H烷基化及烯基化反应。与以前的方法截然不同,在对位选择性地引入对酸敏感的叔丁基,生成1,4-二氢喹啉中间体。然后中间体在3-位发生亲电取代反应,最终叔丁基消除得到所需的产物。该论文通过巧妙地使用一个酸性敏感基团,克服了内在的还原去芳构化和氧化再芳香化过程。这个基团既能启动脱芳香化过程,也能在再芳香化过程中充当离去基团。
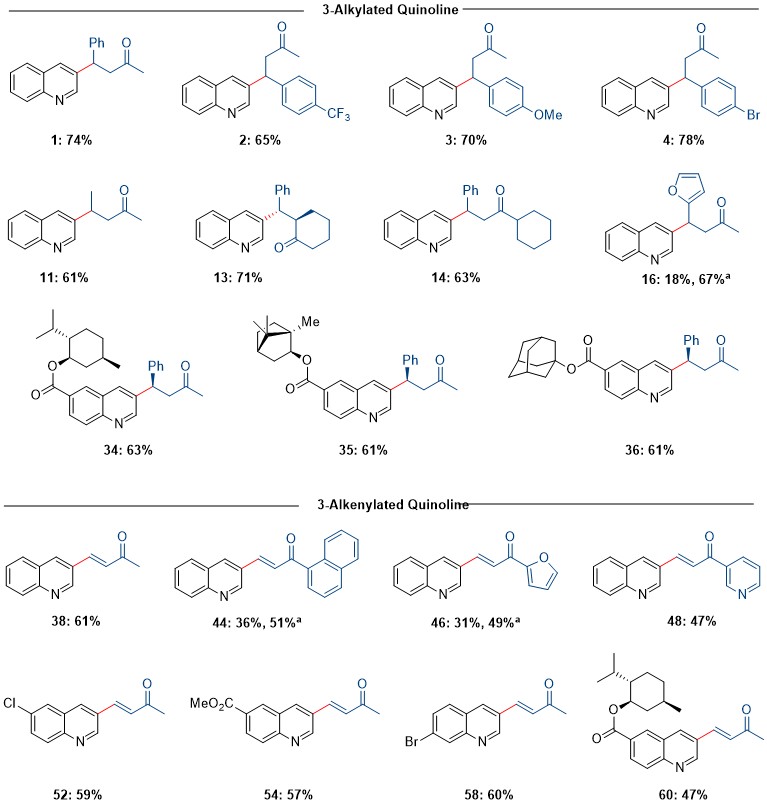
在最优条件下作者对该反应底物适用范围进行了考察。各种取代的喹啉和烯酮可以偶联在一起,以中等到较高的产率合成各种3-烷基化和烯基化喹啉,并且3-位取代的喹啉衍生物是唯一产物。官能团如酯,氰基,硝基,酰基,烷基,芳基,杂芳基和烷氧基都是可耐受的,在过渡金属催化条件下通常是不相容的卤素也是可耐受的。无环烯酮和环烯酮都能与喹啉类化合物顺利反应。该反应对电子效应不敏感,无论缺电子取代基还是富电子取代基,都能以高收率得到产物。烯基化反应中使用甲氧基取代的烯酮为底物,表现出了与烷基化反应类似的底物适用性。
综上,该论文首次成功实现了喹啉C3-H烷基化和烯基化反应,这些反应展现出了卓越的区域和立体选择性。更为引人注目的是,所有这些反应均在没有过渡金属参与,且保持氧化还原中性的条件下顺利完成,为喹啉的转化提供了一种更为环保和经济的方法。
我校研究生许利清及王旭为论文的共同第一作者,王栋教授为唯一通讯作者,我校为论文完成的唯一单位。该工作得到了国家自然科学基金及自治区杰出青年自然科学基金的资助。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/anie.202416451
